Microscopía, histología y patología comparada

Responsable
Ignacio Ruz Caracuel
Personal
Silvia Sacristán (Histología)
Begoña Cuevas (Microscopía)
Pablo Concha
Contacto
Responsable Unidad: ignacio.ruz(ELIMINAR)@salud.madrid.org
Consulta y solicitudes: uca.histologia.irycis(ELIMINAR)@gmail.com
-
Equipamiento
- Criostato CryoStar NX50 para muestras de tejido congeladas.
- Microtomo Microm modelo HM325 para muestras de tejido en parafina.
- Horno de hibridación ACD HybEZ II.
- Tissue microarrayers.
- Campana extractora
- Microscopio confocal Nikon ECLIPSE Ti con sistema de adquisición de imágenes.
- Microscopio invertido de fluorescencia Zeiss Axio Observer 7 – Infraestructura financiada por el Instituto de Salud Carlos III (ISCIII) y los fondos Next Generation EU (IFEQ21/00175)

- Microscopio de fluorescencia ECLIPSE Ci equipado con cámara Nikon DS-Ri1.
- Microscopio óptico Motic BA310 equipado con cámara MOTICAMS3.
- Estación de trabajo para el análisis de imagen. Software NIS ELEMENTS.
- Inmunoteñidor automático Leica Bond Rx
-
Destacables
- Cartera de servicios con técnicas histológicas básicas (en tejidos parafinados y congelados), inmunohistoquímica, inmunofluorescencia, aptahistoquímica, TUNEL y sistemas de detección morfológicos de ARNm.
- Equipo de microscopios ópticos y de fluorescencia, con sistemas de microscopía confocal y de estudio de muestras in vivo mediante fluorescencia.
- Asesoramiento en la interpretación de secciones histológicas humanas y de modelos animales por patólogos.
- Adquisición de imágenes histológicas y asesoramiento para la cuantificación mediante softwares de uso libre (Fiji, QuPath).
-
Cartera de servicios
**Consultar tarifas con la unidad
-
SERVICIO
DESCRIPCIÓN
Preparar un bloque de parafina - Tanda 10 bloques
Incluye la deshidratación de las muestras en sucesivos alcoholes de concentración creciente, aclarado en xilol e inclusión en parafina
Rehacer un bloque de parafina
Incluye estufar el bloque y realinear el plano del tejido en la nueva inclusión en parafina
Cortar un bloque de parafina
Realizar secciones de la muestra incluida en parafina, de espesor entre 5 y 20 micras, flotación de las secciones en un baño caliente y montaje de las secciones sobre portaobjetos. Se utilizarán portaobjetos especiales con carga positiva aptos para técnicas de inmunohistoquímica.
Preparar un bloque congelado
Elaboración de bloque para corte y/o almacenamiento en congelación embebido en OCT. Requiere posterior almacenamiento a -70ºC
Cortar un bloque congelado
Realizar secciones de la muestra congelada en un criostato a una temperatura de -20ºC (puede variar según la dureza del tejido), obteniendo secciones de espesor de 10 micras o mayor, con montaje de las secciones en portas especiales con carga positiva, aptos para inmunohistoquímica.
Tinción de Hematoxilina y Eosina
Tinción histoquímica con reactivo de Schiff y contraste con hematoxilina de Harris o Carazzi. Las secciones se entregarán deshidratadas y montadas con un cubreobjetos
Tinción de PAS - por sección Tinción histoquímica con reactivo de Schiff y contraste con hematoxilina de Harris o Carazzi. Las secciones se entregarán deshidratadas y montadas con un cubreobjetos. Tinción de tricrómico de Masson- por sección
Realización de Tricrómico de Masson variante de Goldner. Las secciones se entregarán deshidratadas y montadas con un cubreobjetos.
Inmunofluorescencia
Realización de técnica de inmunofluorescencia con uno o varios anticuerpo/s en secciones montadas en portaobjetos. La detección del anticuerpo se realizará con anticuerpos secundarios conjugados a fluorocromo/s. Las secciones se entregarán en medio de montaje acuoso marcadas con DAPI o Hoechst. *El anticuerpo primario será suministrado por el cliente. Coste por tanda de 10 muestras.
Inmunohistoquímica
Realización de técnica de inmunohistoquímica con un anticuerpo primario en secciones montadas en portaobjetos. Para la detección del anticuerpo se utilizará una técnica de amplificación por peroxidasa. Los núcleos de las células se teñirán suavemente con hematoxilina de Harris. Las secciones se entregarán deshidratadas y montadas con un cubreobjetos. *Inmunotinciones múltiples y puesta a punto de nuevos anticuerpos consultar con la UCA. Aptahistoquímica
Detección de proteína diana en muestras de tejido parafinado con un aptámero marcado siguiendo metodología Inmunohistoquímica. *El aptámero será suministrado por el cliente. Coste por tanda de 10 muestras.
TUNEL
Detección de células apoptóticas por el sistema fluorométrico TUNEL DeadEnd. Coste por tanda de 10 muestras.
RNAscope
Detección de RNAm en muestras de tejido fijado en formol e incluido en parafina mediante microscopía óptica. Tanto el kit como las sondas corren a cuenta del cliente. Coste por tanda de 10 muestras.
Construcción de micromatriz tisular (TMA)
Construcción de micromatrices tisulares (TMA) a partir de bloques y secciones previamente seleccionados. Incluye marcaje de áreas de interés por un patólogo. La construcción del TMA se realizará en gradillas de 36 cores con un diámetro de 2 o 3 mm. Se entregará con una sección teñida con hematoxilina-eosina. *Si hay que rehacer bloques, el coste se puede incrementar
Microscopía confocal (equipo Nikon ECLIPSE Ti)
Obtención de imágenes de microscopía confocal procedentes de muestras fijadas (Imágenes de múltiple marcaje, experimentos de colocalización multipunto (X,Y,Z), FRAP. *4 horas gratis mensuales a investigadores IRYCIS sin proyecto activo. *El uso de la unidad de trabajo con el NIS-ELEMENTS de forma individual es gratuito
Microscopía confocal in vivo (equipo Zeiss)
Estudio de muestras in vivo (cultivos celulares con marcadores fluorescentes) a lo largo de una secuencia temporal mediante un sistema de incubación celular de cabina con control de la temperatura, humedad, y de gases y con sistema de perfusión.
Escaneado de sección
Digitalización de preparaciones. Los archivos se entregarán en formato .tiff. El cliente debe proporcionar un dispositivo de almacenamiento electrónico
Análisis de imagen y patología comparada
Soporte técnico y metodológico para la adquisición, cuantificación y el análisis de imágenes. La UCA puede asesorar en el empleo de programas de código abierto como FIJI o QuPath
Formación en programas de análisis de imágen
Valoración e interpretación de secciones histológicas de muestras humanas o modelos animales realizadas por un patólogo. Incluye interpretación y cuantificación de biomarcadores. Si se requiere se entregará informe con descripciones histológicas. El asesoramiento a miembros del IRYCIS será gratuito.
Apoyo técnico en Histología
Puesta a punto de nuevos protocolos de técnicas histológicas.
Cuantificación y análisis morfométrico
Técnicas histológicas manuales con protocolos ad hoc.
Búsqueda de bloques y preparaciones en archivo. Organización del material
Formación en técnicas histológicas.
Prosección y tallado de piezas de modelos animales.
Uso instalaciones Histología - básico Uso de la estación de trabajo equipada con programas avanzados de análisis de imagen y alta capacidad de computación (sin apoyo técnico).
-
-
Galería de imágenes
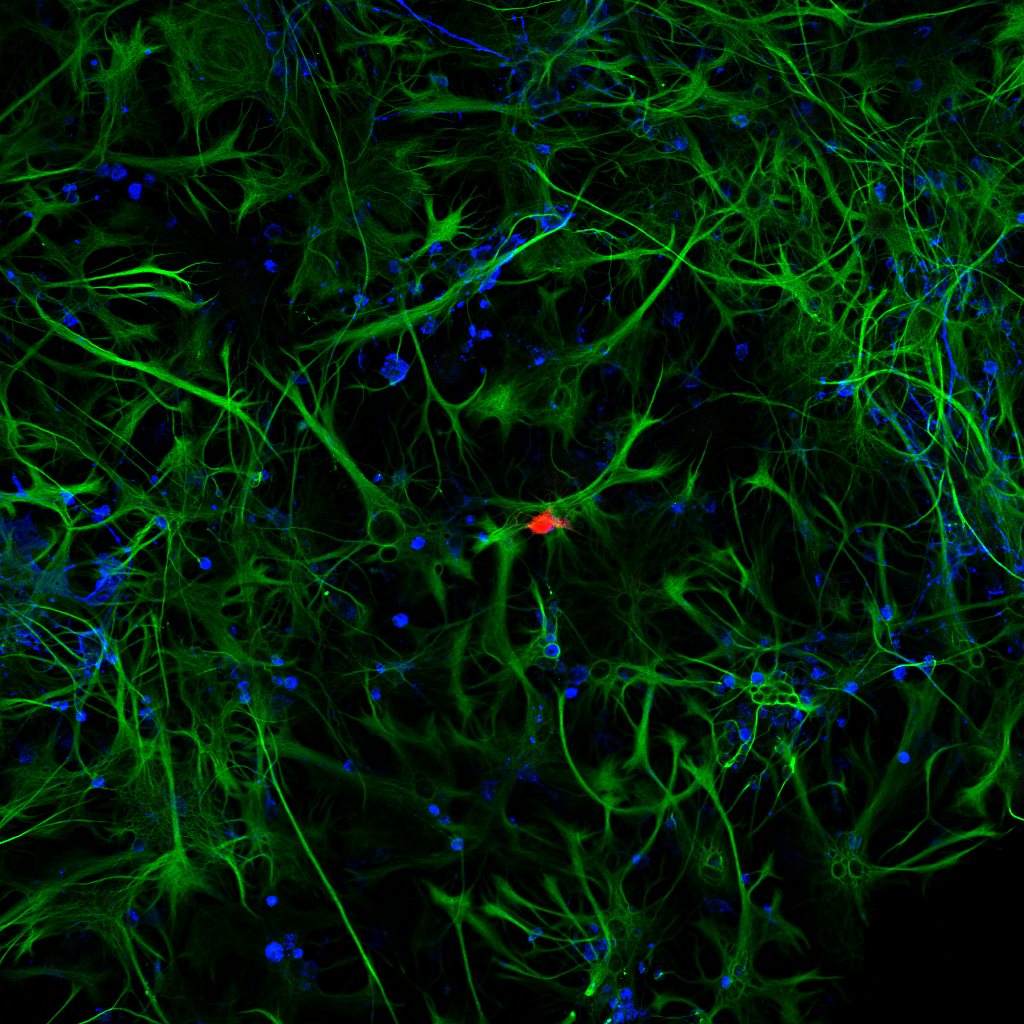
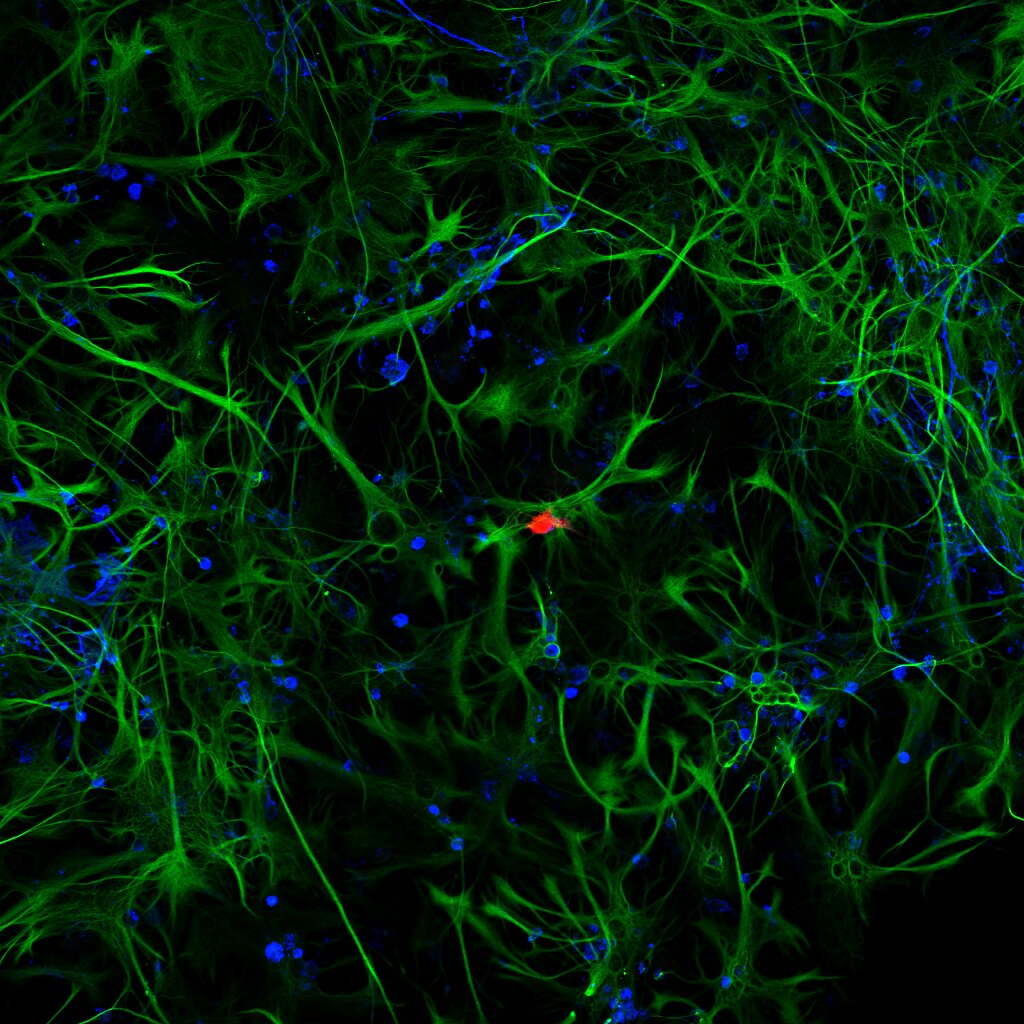
1-Cultivos de astrocitos de rata. Plan Apo 20x. Microscopio Confocal Nikon Eclipse Ti.
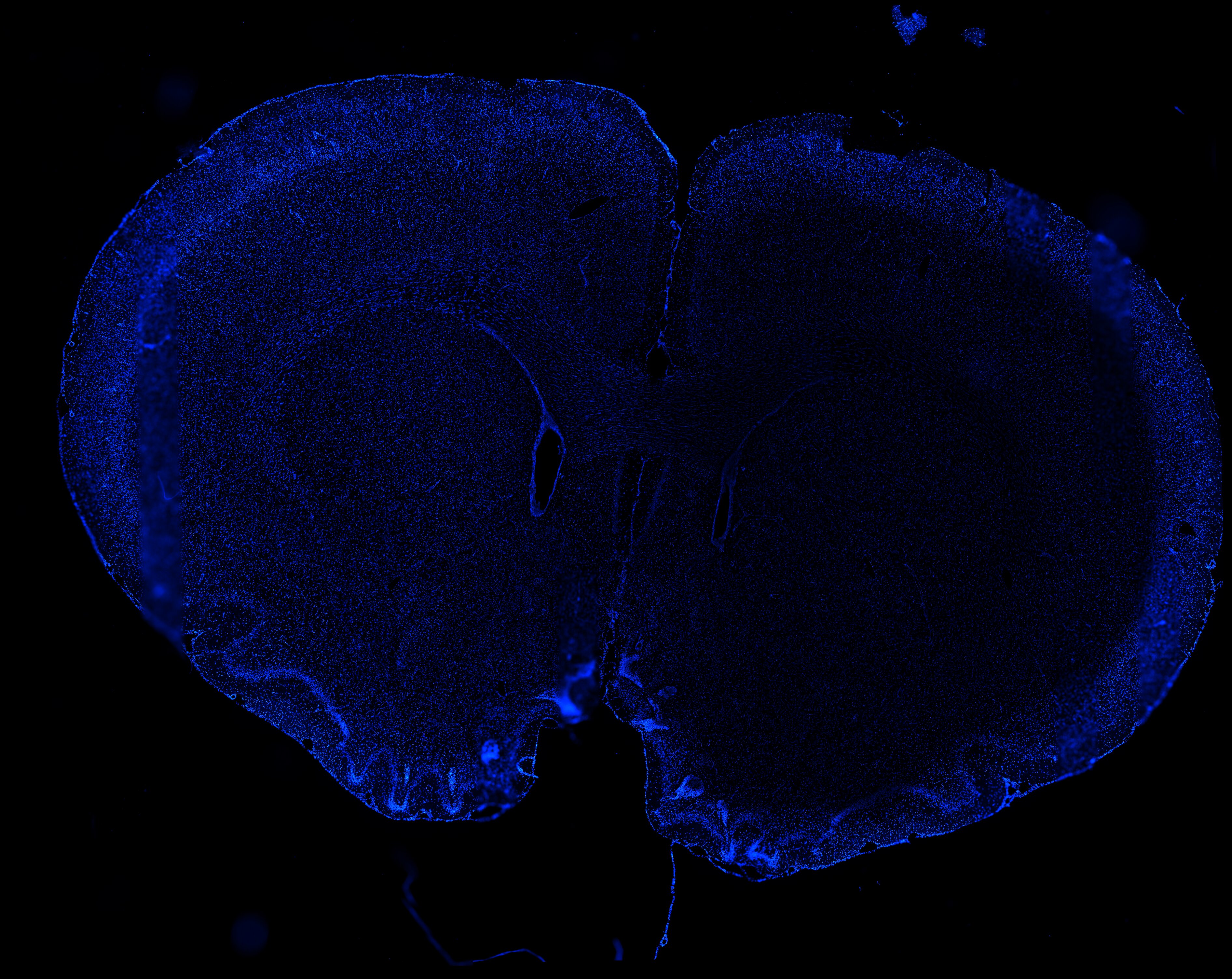
2-Hipocampo de rata. Plan Apo 60x oil. Microscopio Confocal Nikon Eclipse Ti.
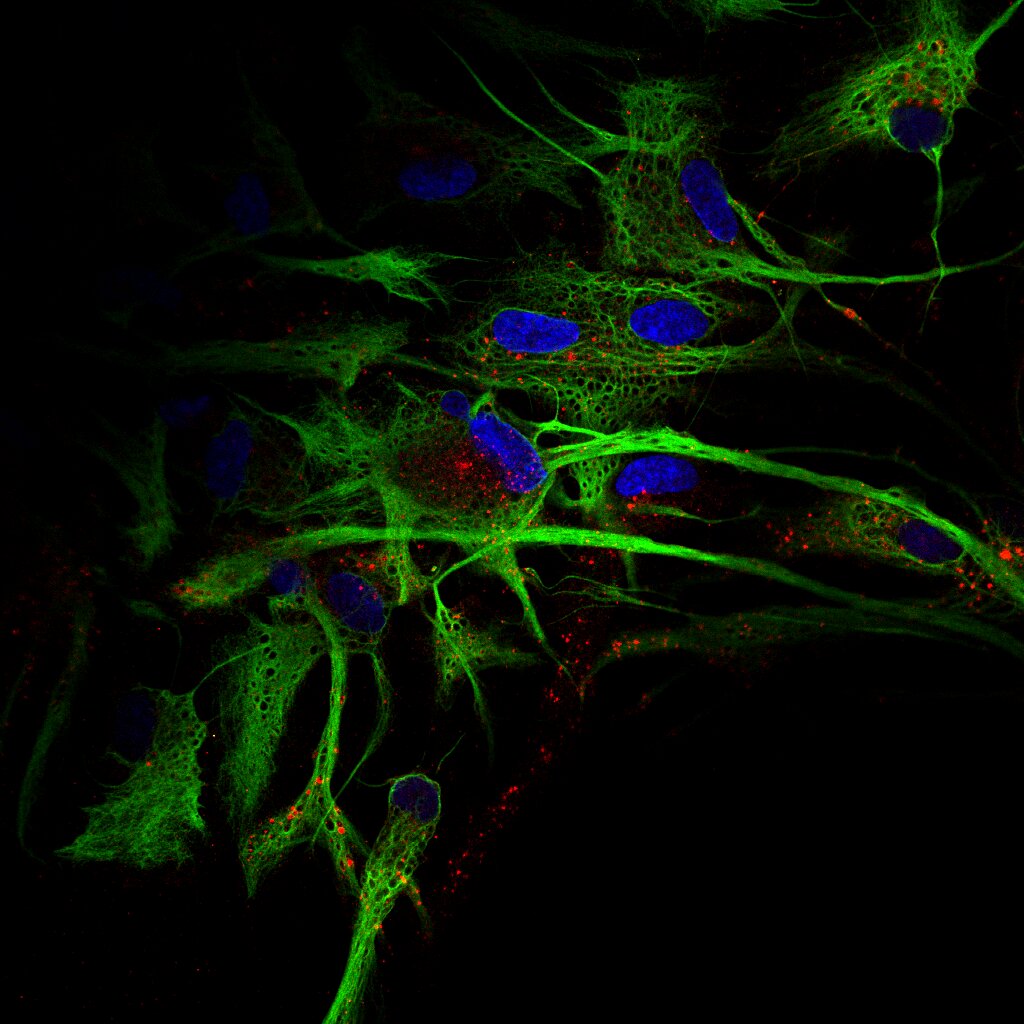
3-Cultivos celulares de neuronas de rata (neuritas), OI Cherry GFAP. Plan Apo 20x.Microscopio Confocal Nikon Eclipse Ti
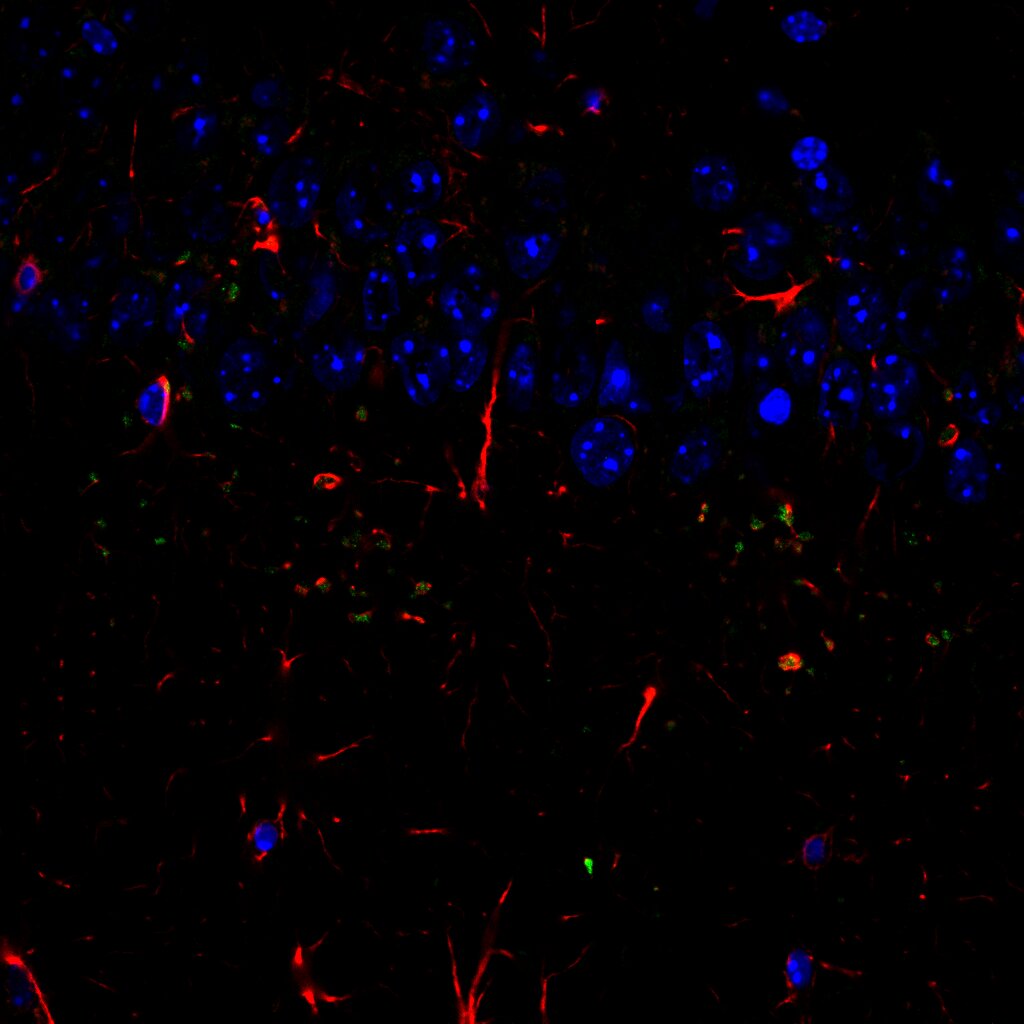
4-Corte frontal de cerebro de rata. Plan Fluor 10x. Microscopio Confocal Nikon Eclipse Ti
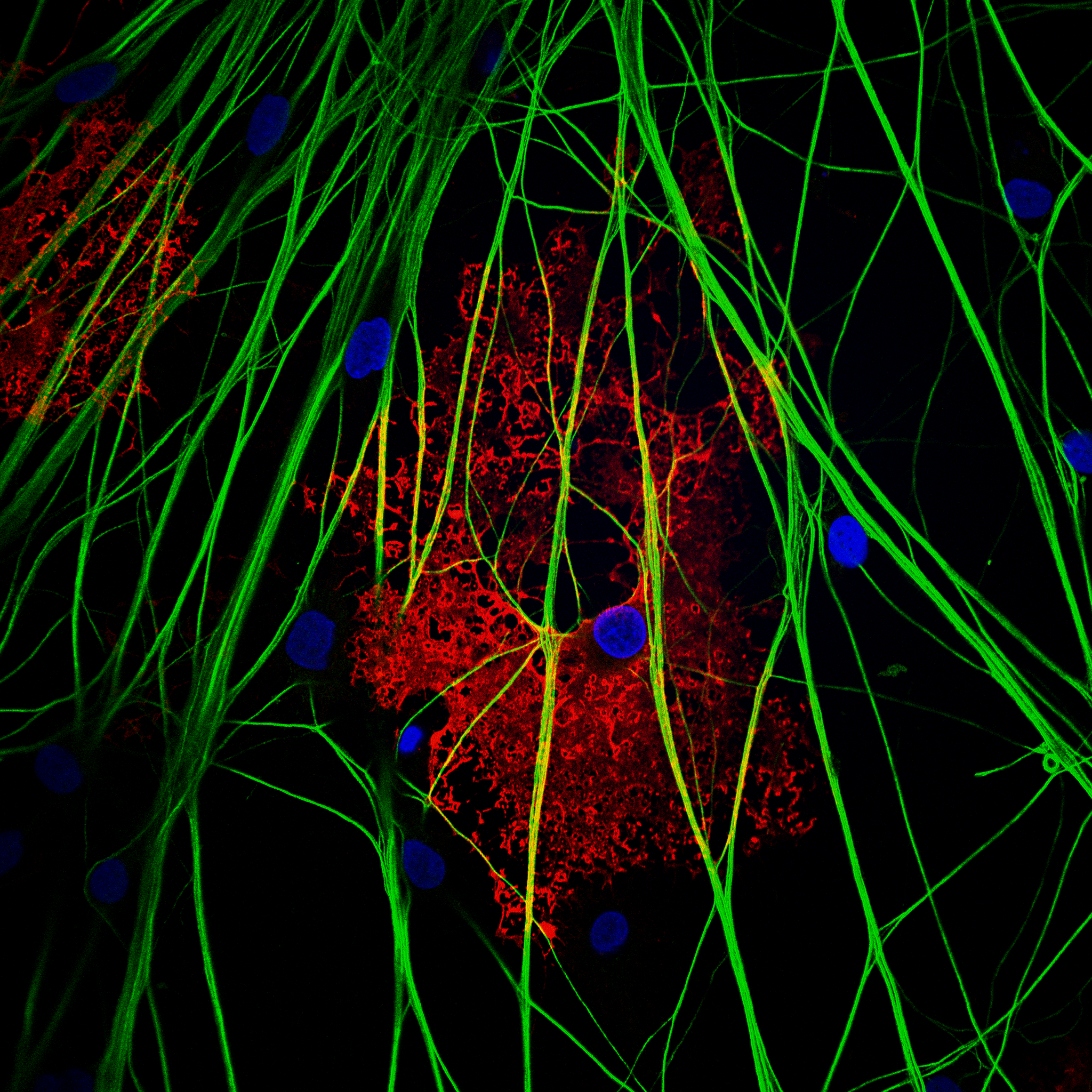
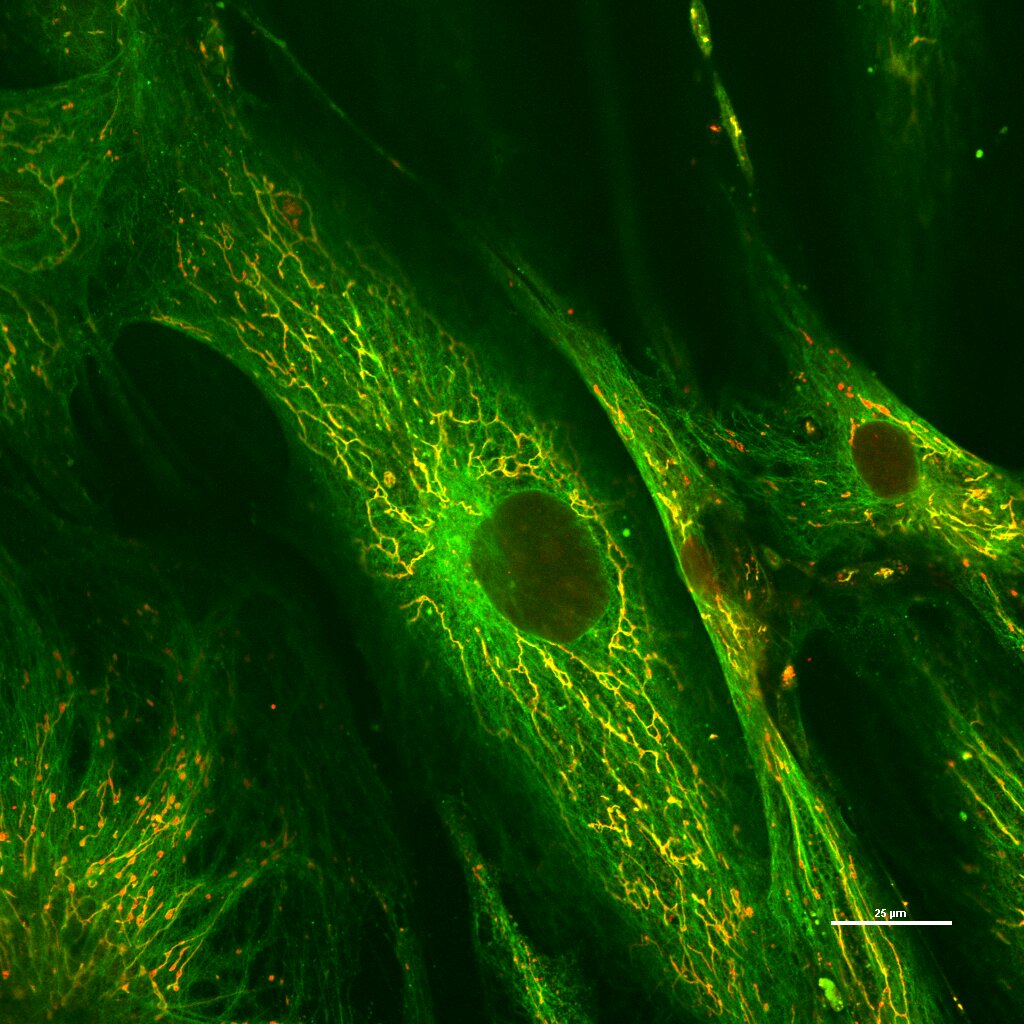
5-Fibroblastos humanos. Marcaje de mitocondrias. Análisis de colocalización. Plan Apo 60x oil. Microscopio Confocal Nikon Eclipse Ti

6-Cultivos celulares de oligodendrocitos de rata. Plan Apo 60x oil. Microscopio Confocal Nikon Eclipse Ti.
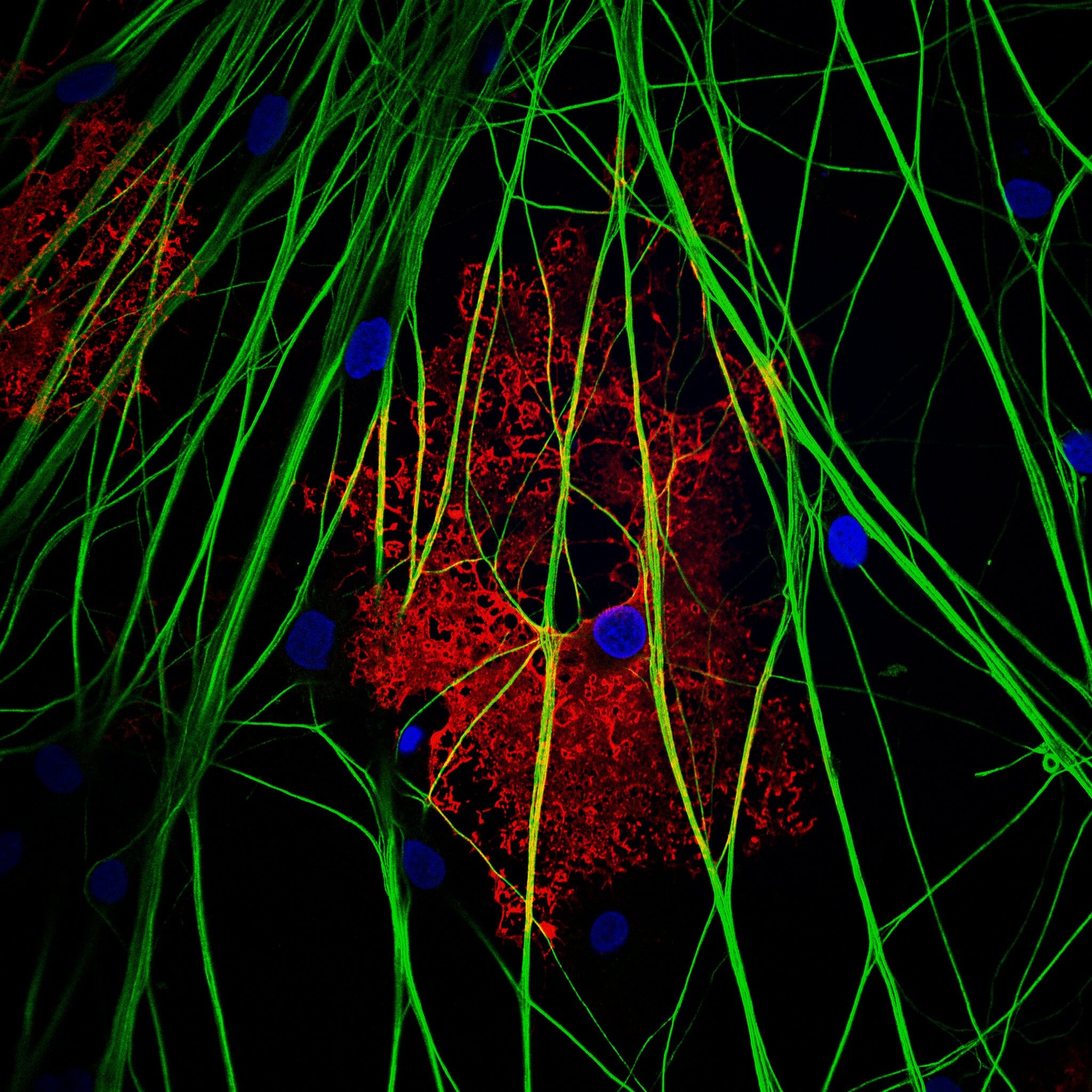
7-Aptahistoquímica anti-vrk1 (marcaje nuclear) en cáncer de mama. 20x. Microscopio óptico Motic BA310.
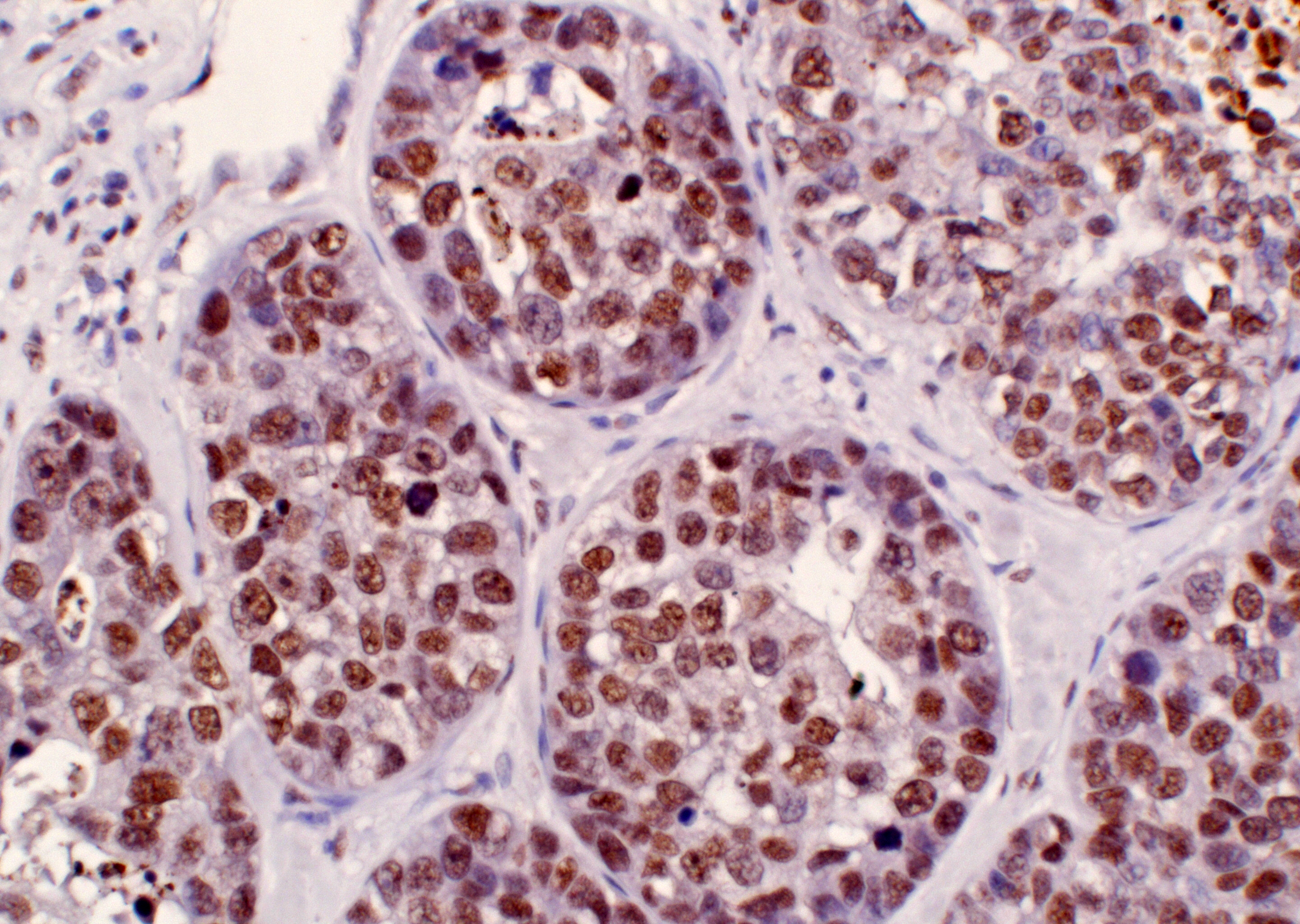
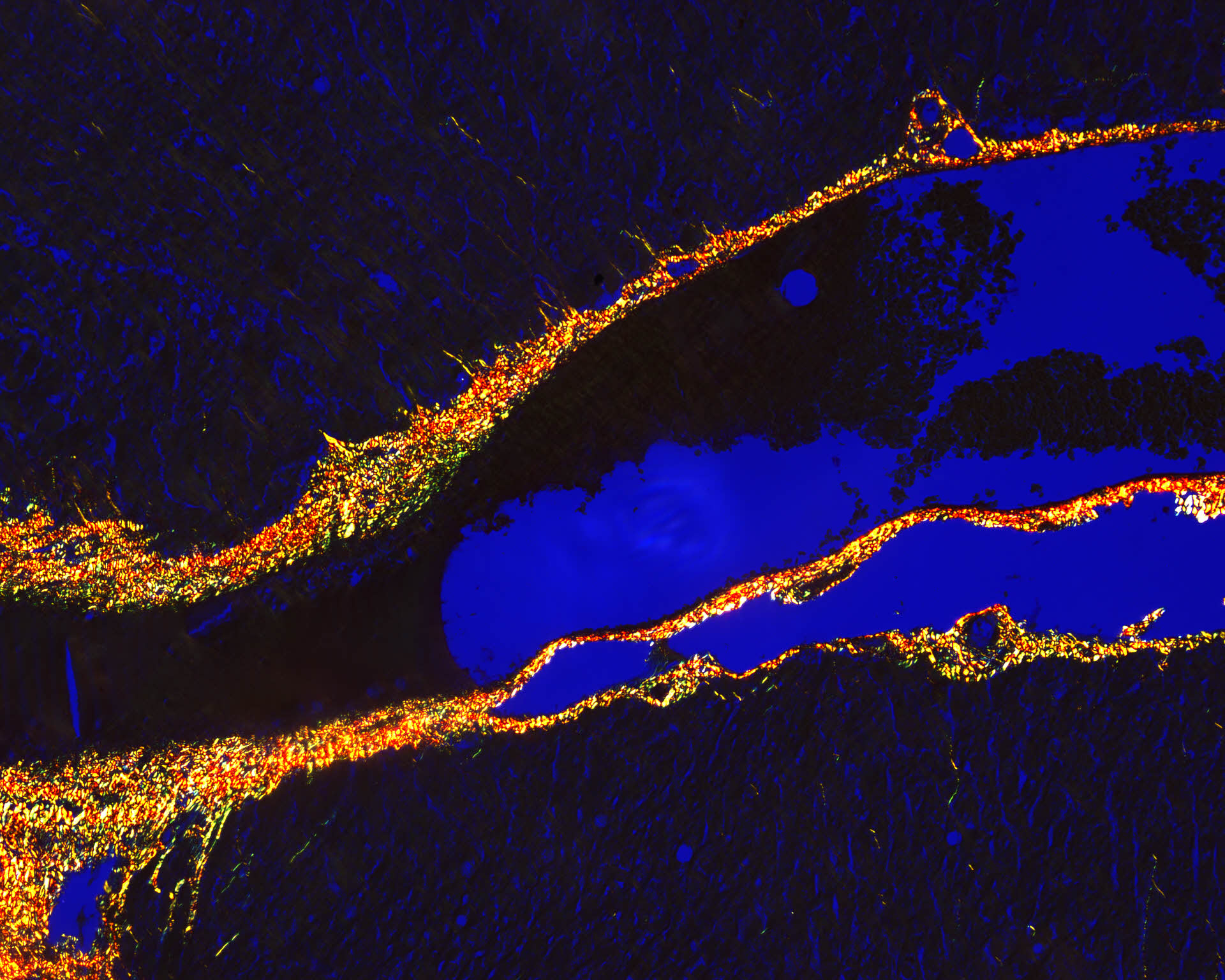
8-Tinción histológica de Rojo Sirio para identificación de fibras elásticas mediante luz polarizada en hígado murino. 10x. Microscopio óptico Motic BA310.