Biobanco y biomodelos

Responsable
Sonia Camaño Páez
Personal
- BIOBANCO
- Bárbara Luna (Coord. Biobanco)
- Sofía Pérez (Resp. Lab)
- BIOMODELOS
- Bruno Sainz (Coord. modelo in vivo- PDX)
- Laura Ruiz (Resp. Lab. modelo in vivo)
- Julie Earl (Coord. modelo in vitro / líneas celulares /organoides)
Contacto
biobanco(ELIMINAR)@salud.madrid.org
Telf 1: 91 336 80 00 Extensión: 7955
Telf 2: 91 336 90 75
Planta -4 derecha
-
¿Qué es un biobanco?
Los Biobancos son unidades de apoyo a la investigación que actúan de nexo de unión entre donantes, personal clínico y de investigación, cuya finalidad es la de crear colecciones de muestras y datos clínicos asociados de distintas patologías. Estas colecciones son gestionadas por Biobanco, quien garantiza el cumplimiento de los requisitos establecidos a nivel social, ético y de calidad. Además, disponen de capacidad para adaptarse a las necesidades derivadas del personal investigador para poder llevar a cabo un proyecto de investigación concreto.
La actividad del Biobanco se caracteriza por:
- Biobanco autorizado por la Consejería de Sanidad (Registro Nacional de Biobancos B.0000678)
- Control de procesos: Sistema de Gestión de la Calidad según la norma UNE-EN ISO 9001:2015. Certificado por SGS ICS (Nº. ES13/14407).
- Tener garantía de calidad, seguridad y trazabilidad de los datos y muestras biológicas almacenadas.
- Cumplimiento de la legislación y normativa aplicables, para garantizar los derechos de los donantes.
- Gestión informática con condiciones de seguridad de nivel alto. Gestión integral de los procesos, trazabilidad de muestras y datos asociados.
- Registro de las condiciones preanalíticas de las muestras (Código Internacional SPREC y condiciones de las muestras)
- Codificación internacional de patologías
- Protocolos de trabajo estandarizados
- Control y seguridad de medios isotermos, conectados a grupo electrógeno, con medición y registro continuo de la temperatura, gestión de alarmas y procedimiento en caso de contingencia.
- Capacidad de coordinación entre distintos servicios/unidades para la generación de colecciones complejas.
- Establece conexiones entre grupos de investigación à proyectos multicéntricos
Almacenar muestras y datos en un Biobanco facilita que puedan ser usados en cualquier proyecto de investigación externo, permitiendo establecer colaboraciones en los proyectos o firmando políticas de autorías entre las personas implicadas.
PERSONAL
Biobanco
- Sonia Camaño (Dirección Científica y Responsable de Calidad)
- Bárbara Luna (Coordinación Técnica Responsable de Formación)
- Sofía Pérez (Responsable de Laboratorio)
- Matilde Serrano (Personal Técnico de Laboratorio)
Biomodelos:
- Bruno Sainz (Coordinación de modelos in vivo-PDX)
- Laura Ruiz (Responsable de modelos in vivo-PDX)
- Julie Earl (Coordinación de modelos in vitro-Líneas celulares y Organoides)
- Jorge Villalón (Personal Técnico de Laboratorio)
- Javier Rumín (Personal Técnico de Laboratorio)
Principales colaboradores/as:
- Ignacio Ruiz (Personal facultativo en Anatomía patológica)
- Amparo Berlinches (Personal facultativo en Anatomía patológica)
- María Eugenia Reguero (Personal facultativo en Anatomía patológica)
- Estefanía Romio (Personal facultativo en Anatomía patológica)
- Nicolás Moreno (Jefe de servicio de Cirugía torácica)
- Sara Frá (Personal facultativo de Cirugía torácica)
- Federico Soria (Jefe de servicio del Animalario y Cirugía experimental y responsable de la UCA Animalario y cirugía experimental)
- María Laura García Bermejo (Responsable de grupo Biomarcadores y dianas terapéuticas)
CIRCUITO DE COLECCIONES DE MUESTRAS BIOLÓGICAS, BIOMODELOS Y DATOS
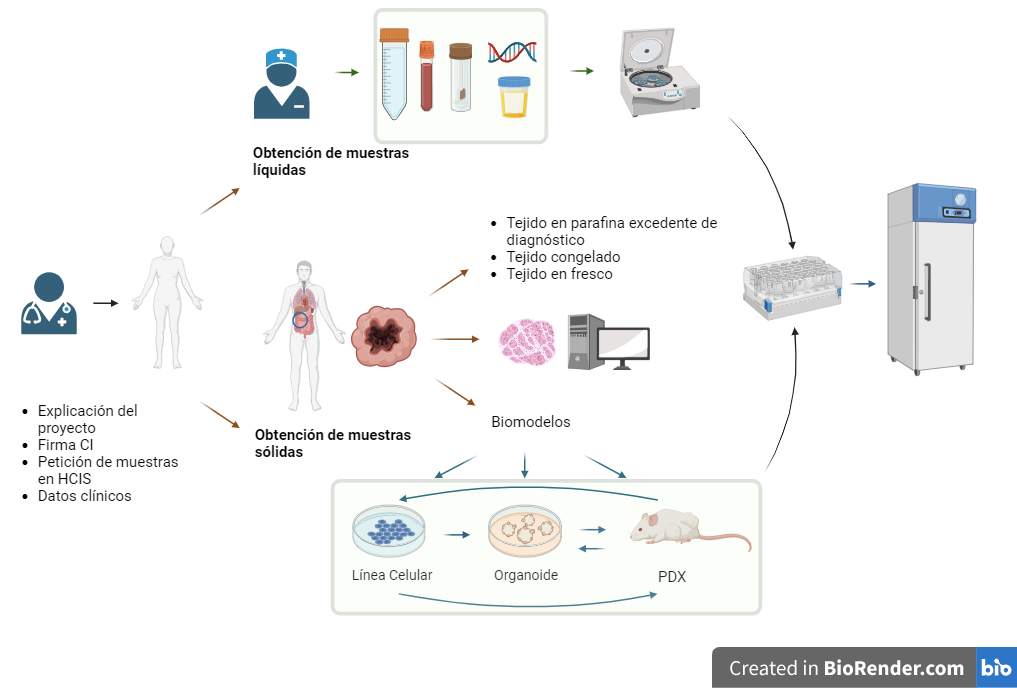
-
Equipamiento
- Congeladores -80ºC y -20º.
- Sistemas de control de temperatura y gestión de alarmas.
- Tanques de Nitrógeno.
- Lector de códigos bidimensionales TRACKER de los tubos de almacenamiento de muestras.
- Sala de cultivos celulares.
- Contador de células automático
- Centrífugas refrigeradas.
- Aplicación web para la gestión de muestras y datos clínicos de Biobanco. Registro y explotación de las muestras, así como la gestión del espacio de los almacenes (NorayBanks, NORAYBIO)
-
Muestras líquidas y sólidas
En Biobanco se gestionan, procesan y almacenan muestras líquidas y sólidas para su uso en investigación.
En el catálogo se puede consultar la información de las colecciones relativa a la patología asociada, nº de casos, tipo de muestras, tiempos de extracción, condiciones de procesamiento, criterios de inclusión, depositario y estado del reclutamiento activo/inactivo.
Las colecciones marcadas con un (*) disponen no solo de la información mínima asociada a la donación y a las muestras, sino también de información adicional en al menos un 80% de los casos. Es información está definida de forma específica para cada una de las patologías en colaboración con el Depositario responsable del fondo de muestras. Estos datos pueden ser de carácter clínico, de seguimiento, antropométricos, bioquímicos, tratamiento farmacológico, hábitos, antecedentes familiares, etc. Se pueden consultar en el ANEXO CUADERNOS DE DATOS ASOCIADOS A LAS MUESTRAS
DESCARGAR CATÁLOGO DETALLADO DE MUESTRAS
Derivados Hemáticos
Muestras de suero, plasma, sangre sin plasma, sangre completa o células a viabilidad.
Otras muestras líquidas
Heces, saliva, pelo, orina, líquido de lavados bronquioalveolares, entre otros.
Tejidos
El uso de tejido siempre será excedente de diagnóstico, sin que suponga un riesgo para el diagnóstico clínico de pacientes, siendo siempre supervisado por profesionales expertos de Anatomía Patológica.
Bloques de tejidos congelados en OCT, tejido congelado en fresco, tejido en fresco, tejido de PDX congelado a viabilidad y tejido de PDX en fresco.
Gestión de los bloques incluidos en parafina del archivo de Anatomía Patológica excedente de diagnóstico.
COLECCIONES DE MUESTRAS LÍQUIDAS Y SÓLIDAS
I. Enfermedades renales
Fracaso renal en la cirugía cardiaca con circulación extracorpórea* (43 casos)
Fracaso renal agudo* (31 casos)
Donantes con criterios expandidos y receptores de trasplante renal (39 donantes y 54 receptores de riñón)
Receptores de trasplante renal (27 casos)
Enfermedad renal crónica y aguda (70 casos; 64 crónica y 6 aguda)
Patología glomerular de riñón* (90 casos)
Predisposición al fracaso renal agudo asociado a la cirugía cardiaca* (68 casos)
Glomerulonefritis membranosa (23 casos)
II. Enfermedades oncológicas
Banco de tumores de muestras de tejido incluido en OCT (2607 casos)
Cáncer pretratamiento y pre cirugía (615 casos)
Valoración de cáncer familiar o hereditario (1007 casos y sanos)*
Pre-colonoscopia (detección precoz de cáncer colorrectal)* (97 casos)
Cáncer colorrectal (22 casos)
Tumores hipofisiarios (73 casos)
Cáncer de páncreas (familiar y esporádico) y casos de alto riesgo* (463 Casos. 4 Cáncer páncreas familiar, 176 Cáncer páncreas esporádico y 263 sujetos de alto riesgo)
Pre trasplante de progenitores hematopoyéticos* (229casos)
Cáncer de mama (104 casos)
Cáncer de pulmón (I)* (12 casos)
Cáncer de pulmón (II)* (116 casos)
Cáncer de pulmón (III)* Nódulos tumorales (839) Nódulos benignos (40) y Sin nódulos o control (187)
Cáncer de células renales (16 casos)
Tumores digestivos (25 casos)
Cáncer de mama y factores de riesgo asociados (8 casos)
Adenocarcinoma de colon (150 casos)
Tumores ginecológicos (6 casos)
Cáncer de origen desconocido (1 caso)
Cáncer con inmunoterapia* (39 casos)
Transplante de microbiota en cáncer de pulmón avanzado tratado con inmunoterapia (23 casos)
Cáncer de pulmón y familiares convivientes* (33 casos y 25 control)
Glioblastoma (11 casos)
Sarcoma (9 casos)
Cáncer de Tiroides. Tratados (100 casos)
Leucemia Mieloide Aguda (59 casos)
Cáncer Recto Estadios II-III tratados con RT (17 casos)
Cáncer de pulmón no células pequeñas avanzados tratados con inmunoterapia (18 casos)
Carcinoma urotelial de vejiga (23 casos)
Cáncer gástico (4 casos)
Tumores neuroendocrinos de origen gastroenteropancreáticos (8 casos)
Tumores de tiroides II (7 casos)
Cáncer de riñón metastásico (7 casos)
Terapia nutricional perioperatoria universal en pacientes con cáncer esofágico, gástrico y pancreático (25 casos)
III. Enfermedades metabólicas
Enfermedades metabólicas óseas* (8 casos)
Diabetes mellitus tipo 2 (144 casos)
Obesidad (I)* (114 casos)
Obesidad (II)* (40 casos y 20 control)
Obesidad. Seguimiento pacientes de cirugía bariátrica (40 casos)
IV. Enfermedades cardiovasculares
Tromboembolia pulmonar (560 casos)
Arteriopatía coronaria (81 casos)
Sospecha de infarto agudo de miocardio (13 casos)
Cardiopatías familiares y miocardiopatías (365 casos)
Infarto agudo de miocardio (I) (237 casos)
Síndrome coronario agudo en menores de 55 años* (53 casos y 41 control)
Insuficiencia cardiaca crónica (100 casos)
Insuficiencia triscúspide aislada (156 casos y 51 control)
Activación mastocitaria en síndrome coronario agudo (11 casos)
Insuficiencia cardiaca II (16 casos)
Insuficiencia cardiaca en pacientes muy ancianos (189 casos)
Enfermedad coronaria (50 casos)
Hipertensión arterial en pacientes con coartación aórtica (57 casos)
V. Enfermedades hepáticas
Enfermedad hepática crónica (675 casos)
Enfermedad hepática vascular (237 casos)
Enfermedad pancreáticobiliar (6 casos estenosis biliar)
VI. Enfermedades neurológicas
Enfermedad de Huntington* (25 casos)
Ictus* (9 casos)
Neurodegenerativas* (160 casos)
VII. Enfermedades Dermatológicas
Alopecia frontal fibrosante y foliculitis decalvante (326 alopecia frontal fibrosante, 34 foliculitis decalvante y 23 miembros de familia)
Psoriasis* (120 casos)
Psoriasis y dieta mediterránea (19 casos y 19 control)
Alopecia areata total o universal* (107 casos)
Dermatitis atópica* (53 casos y 33 control)
Microbiota intestinal en areata grave (4 casos)
Dermatitis atópica y tratamientos sistémicos (25 casos)
Microbiota en pacientes con tumores cutáneos en tratamiento sistémico (5 casos)
VIII. Enfermedades multiorgánicas
Fallo multiorgánico* (83 casos)
IX. Enfermedades infecciosas
Sepsis grave (53 casos)
COVID-19* (703 casos)
VIH con tratamiento estable y NAIVE (259 casos)
HPV (81 casos)
X. Enfermedades raras
Esplenomegalias y trombopenias (9 casos)
Fibrosis quística* (41 casos)
Telangiectasia hemorrágica hereditaria* (100 casos)
Arteritis de células gigantes (15 casos y 15 control)
Ataxia/Paraparesia espástia hereditaria* (73 casos)
Enfermedad de Fabry (16 casos y 16 control)
Tacrolimus en telangiectasia hemorrágica hereditaria (21 casos)
XI. Enfermedades sistémicas y autoinmunes
Enfermedades sistémicas y autoinmunes (250 Artritis Reumatoide, 42 Artritis Psoriásica, 73 Lupus Eritematoso Sistémico, 24 Artritis Idiopática, 50 Espondiloartritis, 5 Lupus Eritematoso juvenil, 4 autoinflamatorio, 2 esclerosis sistémica, 1 vasculitis, 1 Neumopatía intersticial con características autoinmunes y 1 Miopatía Inflamatoria)
XII. Enfermedades Alérgicas
Reacciones de hipersensibilidad a anticuerpos monoclonales (62 casos)
Pacientes con mastocitosis y enfermedades mastocitarias (12 casos)
XIII. Controles
Donantes del banco de sangre* (574 casos)
Donantes no tumorales* (73 casos)
-
Biomodelos
COLECCIONES CON BIOMODELOS
- PDXS de enfermedades oncológicas
De origen torácico:
- Adenocarcinoma de pulmón (16 casos)
- Carcinoma de pulmón (7 casos)
- Sarcomas (13 casos)
- Metástasis colon (1 casos)
- Metástasis mama (4 casos)
De origen digestivo:
- Adenocarcinoma de colon (12 casos)
- Adenocarcinoma de Páncreas (11 casos)
- Colangiocarcinoma de Páncreas (2 casos)
- Tumor Neuroendocrino de Páncreas (3 casos)
- ORGANOIDES de enfermedades oncológicas
De origen urinario
- Vejiga (5 casos)
- ORGANOIDES de enfermedades oncológicas
De origen digestivo:
- Adenocarcinoma de colon (4 casos)
* Consultar el número de muestras disponibles de cada caso.
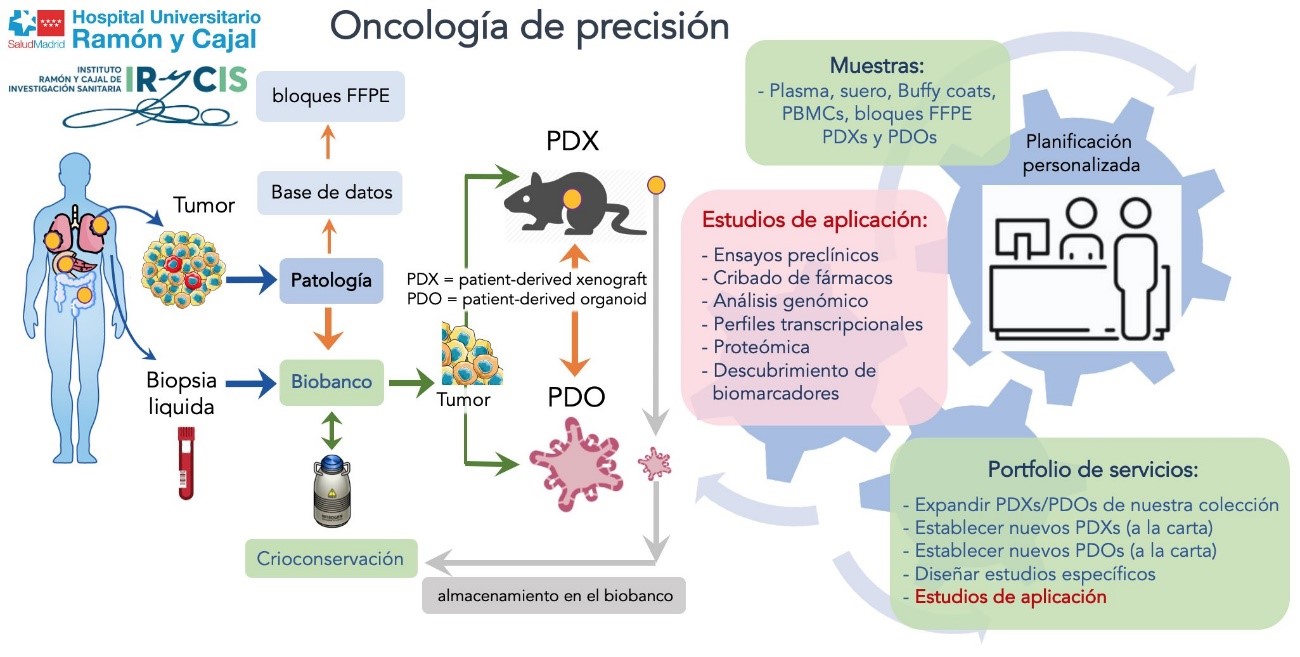
La generación de biomodelos a partir de células extraídas de un órgano humano permite aumentar la cantidad de material biológico para su uso en investigación.
Son réplicas que permiten estudiar soluciones de salud con impacto directo en pacientes y la sociedad. Son un paso clave en el camino de la medicina personalizada.
Biobanco de Biomodelos (in vitro): Cultivo 2D y organoides
Los modelos tumorales in vitro son imprescindibles en la investigación traslacional del cáncer. Permiten identificar nuevas dianas terapéuticas, estudiar la metástasis tumoral, la vascularidad y la matriz extracelular en el mantenimiento y la progresión de los tumores.
Los cultivos monocapa 2D son cultivos adherentes de células en una sola capa medio de cultivo líquido. Son fáciles de cultivar y mantener y constituyen herramientas útiles para estudios básicos (genética, viabilidad, proliferación, vitalidad, etc.). Pueden utilizarse líneas celulares comerciales o establecerse cultivos primarios a partir de muestras tumorales de pacientes.
Los organoides son cultivos autoorganizados que requieren técnicas avanzadas de cultivo celular y medios de cultivo con cócteles específicos de factores de crecimiento y una membrana basal biológica que imite el entorno extracelular. Son más representativos del tumor primario original y constituyen un modelo preclínico útil para la investigación de distintos tipos de tumores. Estos cultivos proporcionan herramientas como los ensayos de cribado de fármacos.Biobanco de Biomodelos (in vivo): Patient derived xenograft (PDX)
El uso de biomodelos es fundamental en las distintas etapas de la investigación biomédica, desde el descubrimiento de moléculas, genes o rutas metabólicas implicadas en enfermedades a los ensayos pre-clínicos de nuevos fármacos.
El Biobanco ha apostado por la investigación oncológica mediante la generación de xenoinjertos derivados de pacientes o PDX (Patient Derived Xenograft). Estos modelos animales se crean mediante el implante directo de una sección de tejido tumoral del paciente en un ratón inmunocomprometido. Este biomodelo es capaz de recapitular y mantener las características del tumor original a nivel molecular y genético, junto con la arquitectura histológica. Esto nos permite estudiar de forma intensiva las alteraciones que originan los tumores y descubrir posibles dianas terapéuticas frente a ellas. Además, estos PDXs retienen la respuesta farmacológica del paciente permitiéndonos realizar ensayos de eficacia de compuestos alternativos o experimentales.
Cada paciente cuenta con su propio biomodelo (reflejando la diversidad y heterogeneidad poblacionales) con unas características únicas pero con beneficios para toda la sociedad.
-
Cartera de servicios
En base a las posibilidades técnicas y de capacitación del personal del Biobanco, se pueden realizar otros servicios de apoyo a los investigadores interesados, entre los que se encuentran:
- Gestión integral (envíos de muestras nacional e internacionalmente, gestión de datos clínicos, revisión de aspectios bioéticos y asesoramiento sobre manejo de muestras biológicas humanas y Sistema de Gestión de la Calidad).
- Elaboración y redacción de la memoria del proyecto para los procedimientos de solicitud de evaluación del proyecto de investigación ante los órganos pertinentes según el caso (Comité de Ética de Investigación, Órgano habilitador, Comunidad de Madrid y Comité de Ética de Experimentación Animal).
- Apoyo técnico de Ensayos Clínicos
- Apoyo técnico para el procesamiento y preservación de muestras
- Generación de xenoinjertos derivados de paciente (PDX)
- Ensayos preclínicos
-
Tarifas
SERVICIO DESCRIPCIÓN TARIFA COSTE BASE* * Coste interno para el personal del IRYCIS, no se aplican costes indirectos ni el IVA. BIOBANCO 1 Alicuota Suero (250µL-500µl) 9,44 € 2 Alicuota Plasma EDTA (250µL-500µl) 9,41 € 3 Alicuota Sangre EDTA sin plasma ó buffy coat (250µL-500µl) 9,41 € 4 Alicuota Plama CITRATO (250µL-500µl) 9,42 € 5 Células mononucleares PBMCs a viabilidad 14,51 € 6 Células mononucleares PBMCs pellet seco 12,77 € 7 Muestra sin procesamiento, sólo registro y almacenamiento (sangre total, lavado bronquioalveolar, saliva, etc...) 5,18 € 8 Alícuota Heces 6,05 € 9 Alícuota Heces RNAlater 11,44 € 10 Alícuota Orina (250µL-6000µl) o Sedimento (de 10ml) 9,59 € 11 Alícuota de saliva procesada 9,47 € 12 Tejido en bloque congelado OCT Gestión por caso (bloque/cristales) 3,36 € 13 Tejido en bloque/cristal de parafina Gestión por caso (bloque/cristales) 1,70 € 14 Tejido en fresco 16,26 € 15 Tejido congelado 19,38 € 16 Solicitud de cesión de muestras Coste hora Senior 70 € Coste hora Junior 40 € Coste hora Técnico de apoyo 20 € 17 Gestión de envío de muestras Coste hora Senior 70 € Coste hora Junior 40 € Coste hora Técnico de apoyo 20 € BIOMODELOS 18 Establecer PDX Generación de xenoinjerto derivado de paciente (PDX) mediante el implante de una biopsia tumoral humana extraída en acto quirúrgico en un ratón inmunodeprimido. El tumor generado recibe el nombre de px1 y proviene directamente del tejido del paciente. 472,2 € 19 Expandir PDX Generación de xenoinjerto derivado de paciente (PDX) mediante el implante de una biopsia tumoral humana-murina extraída de un ratón inmunodeprimido. El tumor generado recibe el nombre de pase correspondiente (ej. px3- tercer pase del tumor desde la biopsia original) y proviene directamente del tejido del ratón. 494,7 € 20 Expandir PDX (criovial tejido tumoral congelado PDXs) Criovial congelado de xenoinjerto derivado de paciente (PDX) mediante el implante de una biopsia tumoral humana-murina extraída de un ratón inmunodeprimido. El tumor generado recibe el nombre de pase correspondiente (ej. px3- tercer pase del tumor desde la biopsia original) y proviene directamente del tejido del ratón. 185,9 € 21 Expandir PDX + ensayo (5 ratones) Generación de xenoinjertos derivado de paciente (PDXs) para la realización de un ensayo pre-clínico, con un grupo experimental de 5 ratones, incluido el diseño, el tratamiento y la generación de muestras. 1.208,1 € 22 Expandir PDX + ensayo (1 ratón) Generación de xenoinjerto derivado de paciente (PDX) para la realización de un ensayo pre-clínico, incluido el diseño, el tratamiento y la generación de muestras. 241,6 € 23 Establecer organoide Generación de organoides a partir de tejido fresco 412,9 € 24 Pase organoide Mantenimiento/expansión de un cultivo de organoides 241,8 € 25 Bloque Parafina Tejido BIOMODELO Procesamiento del tejido e inclusión en bloque de parafina 10,3 € 26 Sección tejido Porta básico BIOMODELO Corte en microtomo de un bloque de parafina, una sección por cristal
1U=10 portas11,7 € 27 Sección tejido Porta tratado BIOMODELO Corte en microtomo de un bloque de parafina, una sección por cristal
1U=10 portas12,7 € 28 Tinción H&E BIOMODELO Tinción Hematoxilina y Eosina
1U=10 portas11,0 € 29 Escaneo de imágenes 8 cristales/hora 20,8 € 30 Informe CEEA y órgabo habilitado Redacción proyecto de experimentación animal para su presentación en el CEEA y el órgano habilitado.
*Será necesaria una evaluación previa de la documentación presentada por el investigador.298,6 € 31 Linea celular primaria derivada BIOMODELO Línea celular primaria obtenida de la digestión de un tumor PDX (px2-px6). Vial congelado 29,9 € ASESORAMIENTO 32 Asesoría técnica, apoyo técnico, gestión de datos, participación en circuitos Asesoramiento científico, metodológico, ético y de calidad.
Puesta a punto de nuevos protocolos y apoyos técnicos.
Formación e implementación de técnicas. Soporte técnico y metodológico.
Gestión y búsqueda de datos clínicos
Participación en circuitosCoste hora Senior 70 € Coste hora Junior 40 € Coste hora Técnico de apoyo 20 € CUSTODIA 33 Caja formato Wilmut 0,65ml Congelador -80ºC custodia caja 1 mes 1,0 € 34 Caja formato Wilmut 1,4ml Congelador -80ºC custodia caja 1 mes 1,6 € 35 Caja Estándar Blanca 9x9 Congelador -80ºC custodia caja 1 mes 2,5 € 36 Caja formato Wilmut 1,4 ml N2L custodia caja 1 mes 4,7 € 37 Caja Estándar Blanca 9x9 N2L custodia caja 1 mes 6,3 € 38 Caja Estándar Blanca 9x9 Congelador -20ºC custodia caja 1 mes 3,7 €

